22-Giugno-2009
LE ORIGINI DEL BUCO NELL'OZONO: PUBBLICATI SU -SCIENCE- I RISULTATI DI UN LAVORO CONDOTTO DA CNR E UNIVERSITÀ DI BOCHUM
.
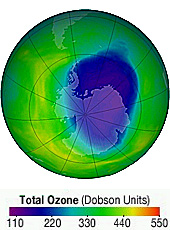
Acido cloridrico che, inspiegabilmente, si dissocia in gocce di acqua di pochi miliardesimi di metro nel gelo della stratosfera: è questo il primo anello, finora inspiegato, della reazione chimica che porta alla formazione del buco nell’ozono. L’enigma è stato ora risolto da Marco Masia del laboratorio SLACS di INFM-CNR e dell’Università di Sassari e dai suoi colleghi dell’Università tedesca di Bochum, che sono riusciti a osservare questa dissociazione a temperatura bassissima e a chiarirne le dinamiche, con una teoria che riesce a spiegare la formazione di molecole complesse in ambienti difficili come il vuoto cosmico o la superficie dei nanocristalli di ghiaccio sulla terra.
Il lavoro, frutto della collaborazione italo-tedesca, è stato pubblicato oggi su "Science", una delle massime riviste scientifiche, con il titolo "Aggregation-Induced Dissociation of HCl(H2O)4 below 1 K: The Smallest Droplet of Acid".
Una reazione inspiegabile. Nella stratosfera, la dissociazione dell'acido nelle nanogocce d'acqua catalizza, cioè favorisce e accelera, la creazione di cloro. È questo cloro che va poi a interagire con l’ozono causandone la scomparsa. Una reazione ben compresa dagli scienziati, tranne che per la sua prima fase: come può avvenire questa dissociazione nella stratosfera, dove la temperatura è bassissima? Perché vi sia una reazione, infatti, le molecole che vi prendono parte devono necessariamente avere sufficiente energia termica (calore) da interagire tra loro. Energia che certamente non posseggono nel gelo di quelle regioni.
Un laboratorio in una goccia. Per risolvere questo enigma, i ricercatori hanno studiato la reazione grazie ai nanoaggregati, molecole piccolissime, le più piccole unità chimiche in grado di prendere parte a reazioni. Questi oggetti microscopici sono stati analizzati grazie a una tecnica innovativa, la spettroscopia infrarossa in elio superfluido, che consente di catturare in una goccia di elio le molecole che compongono il nanoaggregato nel quale avviene la reazione. La piccolissima goccia diventa così un vero e proprio "laboratorio microscopico", nel quale è possibile studiare in dettaglio la massa e le interazioni delle molecole che vi sono intrappolate. Raffreddando questo microlaboratorio al di sotto dei -272°, i ricercatori hanno finalmente potuto osservare "in diretta" il fenomeno di dissoluzione dell'acido.
Meccanica molecolare. La dinamica della dissociazione è semplice: quattro molecole di acqua e una di cloruro di idrogeno vanno ad interagire tra loro all’interno della nanogoccia. E il cloruro, cedendo un protone, fa si che si generi la più piccola goccia d'acido possibile. Ma da dove deriva l’energia per questa reazione? La spiegazione, sostengono gli scienziati, sta tutta in un fenomeno detto di aggregazione molecolare: molecole "lontane" fra loro, anche se dotate di poca energia termica, tendono ad attirarsi e da questo processo di avvicinamento si genera proprio l’energia cinetica e quindi termica necessaria a causare la reazione. Un effetto che avviene nella dissociazione dell’acido nella stratosfera come nella formazione di molecole complesse nello spazio, o più vicino a noi, sulla terra, sulla superficie dei nanocristalli di ghiaccio.
|